- info@acquadepur.it
- Tel: 0362 - 334152
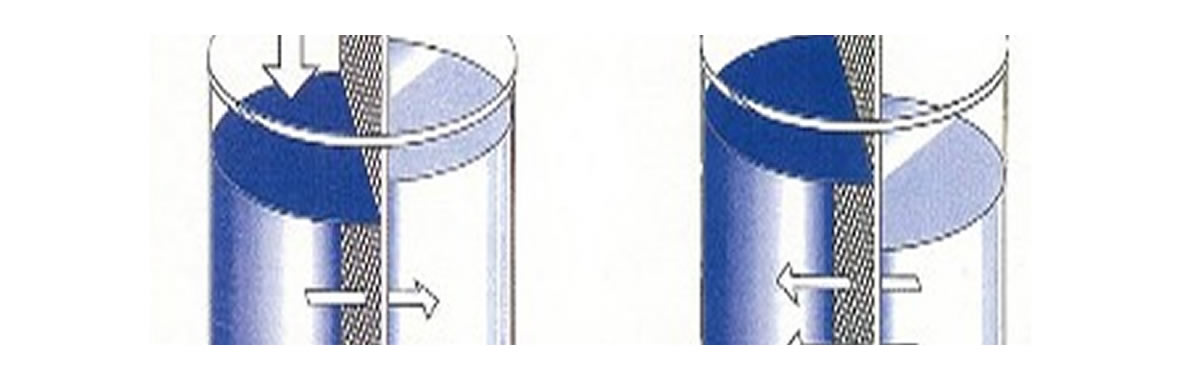
In presenza di una membrana semipermeabile e di due acque a diversa concentrazione salina, l’acqua meno concentrata (piu’ pura) tende ad attraversare la membrana per andare a diluire e quindi a riequilibrare la concentrazione di sali. Questo “passaggio” attraverso la membrana e’ realizzato grazie alla pressione osmostica, che continuera’ ad esercitare una forza sulla soluzione meno concentrata fino ad ottenere due soluzioni con la stessa salinita’.
La pressione osmotica, come si puo’ vedere dalla figura vince la forza di gravita’ e spinge l’acqua nel contenitore a maggior concentrazione.
L’osmosi inversa
Se noi esercitiamo sulla soluzione a piu’ elevata salinita’ una pressione maggiore della pressione osmotica, possiamo invertire il processo, forzando la parte acquosa della soluzione a maggior concentrazione a passare attraverso la membrana: in questo secondo caso solo l’acqua pura riesce ad attraversarla, andando ad incrementare la quantita’ di acqua a minor concentrazione (chiamata permeato) nel contenitore di destra, lasciando ovviamente una soluzione piu’ concentrata di quella di partenza (detta appunto concentrato) nel contenitore che in figura e’ rappresentato a sinistra.